This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഥാലിയം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
| വരി 6: | വരി 6: | ||
ക്രൂക്സൈറ്റ് (Cu,Tl,Ag)<sub>2</sub>Sc, ലോറന്ഡൈറ്റ് (Tl,AsS<sub>2</sub>) എന്നിവയാണ് പ്രധാന അയിരുകള്. വില്യം ക്രൂക്ക് എന്ന ഇംഗ്ലീഷ് ശാസ്ത്രജ്ഞനും ക്ലോദ് അഗസ്തേലാമി എന്ന ഫ്രഞ്ച് ശാസ്ത്രജ്ഞനും 1862-ല് ഥാലിയം വേര്തിരിക്കുന്നതില് സ്വന്തം നിലകളില് വിജയിച്ചു. ഘനലോഹങ്ങളുടെ സള്ഫൈഡ് അയിരുകളില്നിന്ന് ഘനലോഹങ്ങള് നിഷ്കര്ഷണം ചെയ്തശേഷം ലഭിക്കുന്ന അവശിഷ്ടങ്ങളില് നിന്നാണ് വ്യാവസായികമായി ഥാലിയം വേര്തിരിക്കുന്നത്. | ക്രൂക്സൈറ്റ് (Cu,Tl,Ag)<sub>2</sub>Sc, ലോറന്ഡൈറ്റ് (Tl,AsS<sub>2</sub>) എന്നിവയാണ് പ്രധാന അയിരുകള്. വില്യം ക്രൂക്ക് എന്ന ഇംഗ്ലീഷ് ശാസ്ത്രജ്ഞനും ക്ലോദ് അഗസ്തേലാമി എന്ന ഫ്രഞ്ച് ശാസ്ത്രജ്ഞനും 1862-ല് ഥാലിയം വേര്തിരിക്കുന്നതില് സ്വന്തം നിലകളില് വിജയിച്ചു. ഘനലോഹങ്ങളുടെ സള്ഫൈഡ് അയിരുകളില്നിന്ന് ഘനലോഹങ്ങള് നിഷ്കര്ഷണം ചെയ്തശേഷം ലഭിക്കുന്ന അവശിഷ്ടങ്ങളില് നിന്നാണ് വ്യാവസായികമായി ഥാലിയം വേര്തിരിക്കുന്നത്. | ||
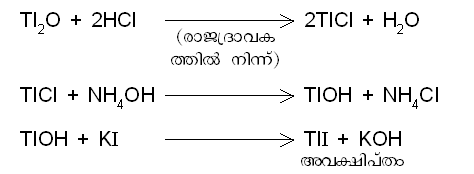
| - | + | [[Image:p236a.png|left]] | |
'''നിഷ്കര്ഷണം'''. സള്ഫൈഡ്, സെലിനൈഡ് അയിരുകള് വിശേഷിച്ചും, കോപ്പര്പൈറൈറ്റിസ് വറുക്കുമ്പോള് (roasting)പുകക്കുഴലില് അടിയുന്ന പൊടിയില്നിന്നാണ് ഥാലിയം നിഷ്കര്ഷണം ചെയ്യുന്നത്. ഈ പൊടിയില് കോപ്പര്, ലെഡ്, ആര്സനിക്, ബിസ്മത്ത്, അയണ് എന്നിവയുടെ ലോഹഓക്സൈഡുകളോടൊപ്പം ഥാലിയം ഓക്സൈഡും (Tl<sub>2</sub>O)അടങ്ങിയിട്ടുണ്ട്. പുകക്കുഴലിലെ പൊടി രാജദ്രാവകത്തില് ലയിപ്പിച്ചശേഷം നൈട്രിക് അമ്ലം ബാഷ്പീകരിച്ച് നീക്കം ചെയ്യുന്നു. തുടര്ന്ന് ലായനിയിലൂടെ ഹൈഡ്രജന് സള്ഫൈഡ് കടത്തിവിട്ട് കോപ്പര്, ലെഡ്, ബിസ്മത്ത്, ആര്സനിക് എന്നിവയുടെ സള്ഫൈഡും അവക്ഷേപിച്ചെടുക്കുന്നു. അരിച്ചെടുത്ത ദ്രാവകം അമോണിയ ചേര്ത്ത് ചൂടാക്കി ഇരുമ്പിനെ ഹൈഡ്രോക്സൈഡായി വേര്തിരിക്കാം. തെളിഞ്ഞ ലായനി പൊട്ടാസിയം അയഡൈഡുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ച് ഥാലിയം അയഡൈഡ് അവക്ഷിപ്തം വേര്തിരിച്ചെടുക്കുന്നു. ഈ അവക്ഷിപ്ത സിങ്കും നേര്ത്ത സള്ഫ്യൂറിക് അമ്ലവും ഉപയോഗിച്ച് അപചയിച്ചാണ് ഥാലിയം വേര്തിരിക്കുന്നത്. | '''നിഷ്കര്ഷണം'''. സള്ഫൈഡ്, സെലിനൈഡ് അയിരുകള് വിശേഷിച്ചും, കോപ്പര്പൈറൈറ്റിസ് വറുക്കുമ്പോള് (roasting)പുകക്കുഴലില് അടിയുന്ന പൊടിയില്നിന്നാണ് ഥാലിയം നിഷ്കര്ഷണം ചെയ്യുന്നത്. ഈ പൊടിയില് കോപ്പര്, ലെഡ്, ആര്സനിക്, ബിസ്മത്ത്, അയണ് എന്നിവയുടെ ലോഹഓക്സൈഡുകളോടൊപ്പം ഥാലിയം ഓക്സൈഡും (Tl<sub>2</sub>O)അടങ്ങിയിട്ടുണ്ട്. പുകക്കുഴലിലെ പൊടി രാജദ്രാവകത്തില് ലയിപ്പിച്ചശേഷം നൈട്രിക് അമ്ലം ബാഷ്പീകരിച്ച് നീക്കം ചെയ്യുന്നു. തുടര്ന്ന് ലായനിയിലൂടെ ഹൈഡ്രജന് സള്ഫൈഡ് കടത്തിവിട്ട് കോപ്പര്, ലെഡ്, ബിസ്മത്ത്, ആര്സനിക് എന്നിവയുടെ സള്ഫൈഡും അവക്ഷേപിച്ചെടുക്കുന്നു. അരിച്ചെടുത്ത ദ്രാവകം അമോണിയ ചേര്ത്ത് ചൂടാക്കി ഇരുമ്പിനെ ഹൈഡ്രോക്സൈഡായി വേര്തിരിക്കാം. തെളിഞ്ഞ ലായനി പൊട്ടാസിയം അയഡൈഡുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ച് ഥാലിയം അയഡൈഡ് അവക്ഷിപ്തം വേര്തിരിച്ചെടുക്കുന്നു. ഈ അവക്ഷിപ്ത സിങ്കും നേര്ത്ത സള്ഫ്യൂറിക് അമ്ലവും ഉപയോഗിച്ച് അപചയിച്ചാണ് ഥാലിയം വേര്തിരിക്കുന്നത്. | ||
12:58, 18 മാര്ച്ച് 2009-നു നിലവിലുണ്ടായിരുന്ന രൂപം
ഥാലിയം
Thallium
ഒരു ലോഹമൂലകം. സിംബല്: Tl. അണുസംഖ്യ: 81, അണുഭാരം: 204.39. ആവര്ത്തന പട്ടികയില് ആറാമത്തെ പിരീഡില് ഗ്രൂപ്പ് III-ല് ഉള് പ്പെടുത്തിയിരിക്കുന്നു. ഭൗമോപരിതലത്തില് 0.00006 % ഥാലിയം അടങ്ങിയിട്ടുണ്ട്. പ്രധാനമായും ഇരുമ്പ്, കോപ്പര് എന്നിവയുടെ സള്ഫൈഡ്, സെലിനൈഡ് അയിരുകളുടെ ഒരു ചെറുഘടകമെന്ന നിലയ്ക്കാണ് ഥാലിയം നിലകൊള്ളുന്നത്.
ക്രൂക്സൈറ്റ് (Cu,Tl,Ag)2Sc, ലോറന്ഡൈറ്റ് (Tl,AsS2) എന്നിവയാണ് പ്രധാന അയിരുകള്. വില്യം ക്രൂക്ക് എന്ന ഇംഗ്ലീഷ് ശാസ്ത്രജ്ഞനും ക്ലോദ് അഗസ്തേലാമി എന്ന ഫ്രഞ്ച് ശാസ്ത്രജ്ഞനും 1862-ല് ഥാലിയം വേര്തിരിക്കുന്നതില് സ്വന്തം നിലകളില് വിജയിച്ചു. ഘനലോഹങ്ങളുടെ സള്ഫൈഡ് അയിരുകളില്നിന്ന് ഘനലോഹങ്ങള് നിഷ്കര്ഷണം ചെയ്തശേഷം ലഭിക്കുന്ന അവശിഷ്ടങ്ങളില് നിന്നാണ് വ്യാവസായികമായി ഥാലിയം വേര്തിരിക്കുന്നത്.
നിഷ്കര്ഷണം. സള്ഫൈഡ്, സെലിനൈഡ് അയിരുകള് വിശേഷിച്ചും, കോപ്പര്പൈറൈറ്റിസ് വറുക്കുമ്പോള് (roasting)പുകക്കുഴലില് അടിയുന്ന പൊടിയില്നിന്നാണ് ഥാലിയം നിഷ്കര്ഷണം ചെയ്യുന്നത്. ഈ പൊടിയില് കോപ്പര്, ലെഡ്, ആര്സനിക്, ബിസ്മത്ത്, അയണ് എന്നിവയുടെ ലോഹഓക്സൈഡുകളോടൊപ്പം ഥാലിയം ഓക്സൈഡും (Tl2O)അടങ്ങിയിട്ടുണ്ട്. പുകക്കുഴലിലെ പൊടി രാജദ്രാവകത്തില് ലയിപ്പിച്ചശേഷം നൈട്രിക് അമ്ലം ബാഷ്പീകരിച്ച് നീക്കം ചെയ്യുന്നു. തുടര്ന്ന് ലായനിയിലൂടെ ഹൈഡ്രജന് സള്ഫൈഡ് കടത്തിവിട്ട് കോപ്പര്, ലെഡ്, ബിസ്മത്ത്, ആര്സനിക് എന്നിവയുടെ സള്ഫൈഡും അവക്ഷേപിച്ചെടുക്കുന്നു. അരിച്ചെടുത്ത ദ്രാവകം അമോണിയ ചേര്ത്ത് ചൂടാക്കി ഇരുമ്പിനെ ഹൈഡ്രോക്സൈഡായി വേര്തിരിക്കാം. തെളിഞ്ഞ ലായനി പൊട്ടാസിയം അയഡൈഡുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ച് ഥാലിയം അയഡൈഡ് അവക്ഷിപ്തം വേര്തിരിച്ചെടുക്കുന്നു. ഈ അവക്ഷിപ്ത സിങ്കും നേര്ത്ത സള്ഫ്യൂറിക് അമ്ലവും ഉപയോഗിച്ച് അപചയിച്ചാണ് ഥാലിയം വേര്തിരിക്കുന്നത്.
ഗുണധര്മങ്ങള്. ചാരനിറത്തോടുകൂടിയ മാര്ദവമുള്ള ഒരു ലോഹമാണ് ഥാലിയം. നഖംകൊണ്ടുപോലും പോറലേല്പ്പിക്കാന് പറ്റുന്ന അത്രയും മാര്ദവമുള്ളതാണ്. അടിച്ചുപരത്താനും നേര്ത്ത കമ്പികളായി വലിച്ചെടുക്കാനും സാധിക്കും. ഉരുകല് നില: 303o, തിളനില: 1457oC, 20oC-ലെ സാന്ദ്രത: 11.8g/cm3.α,β എന്നീ രണ്ട് അലോട്രോപ്പിക രൂപങ്ങളില് സ്ഥിതിചെയ്യുന്നു. കോപ്പര്, സിങ്ക്, വെള്ളി, സ്വര്ണം, കാഡ്മിയം എന്നീ ലോഹങ്ങളുമായി അലോയ്കള് രൂപീകരിക്കുന്നു.
ഥാലിയത്തിന്റെ സംയോജക ഇലക്ട്രോണുകളുടെ വിന്യാസം 6s2 6p1 എന്നാണ്. സംയുക്തകങ്ങളില് +3 സംയോജകത പ്രദര്ശിപ്പിക്കുന്നു. +1, +2 സംയോജകതകളുള്ള ചില സംയുക്തങ്ങളും ഉണ്ട്. ഥാലിയം ലോഹം ഹാലജനുകളും അലോഹങ്ങളുമായി ഥാലിയം (l) സംയുക്തങ്ങള് രൂപീകരിക്കുന്നു. ഥാലിയം (l) ക്ലോറൈഡ്, ബ്രോമൈഡ്, അയഡൈഡ് എന്നിവ അലേയമായതിനാല് ഹാലജനുകളുടെ ജലീയലായനിയില്നിന്ന് നേരിട്ട് അവക്ഷേപിക്കാം. ഥാലിയം ഹാലൈഡുകള് ജലീയ അമോണിയ ലായനിയിലും അലേയമാണ്. ലായനിയില് ഹാലൈഡ് അയോണുകളുടെ സാന്ദ്രത കൂടുമ്പോള് ലേയമായ Tl എന്നീ സങ്കീര്ണ അയോണുകള് രൂപീകൃതമാകുന്നതുമൂലം ഥാലിയം ഹാലൈഡ് ലേയമായിത്തീരുന്നു.
Tl(I) ഓക്സൈഡ് കറുത്ത നിറത്തിലുള്ള പൊടിയാണ്. ഓക്സൈഡിന്റെ ജലീയ ലായനിയില്നിന്ന് മഞ്ഞനിറമുള്ള ഥാലിയം ഹൈഡ്രോക്സൈഡി(TlOH)ന്റെ പരലുകള് വേര്തിരിക്കാനാവും. ഗാഢ ക്ഷാരസ്വഭാവം പ്രദര്ശിപ്പിക്കുന്ന ഹൈഡ്രോക്സൈഡ് അന്തരീക്ഷത്തില്നിന്ന് കാര്ബണ് ഡൈഓക്സൈഡിനെ സ്വാംശീകരിക്കുന്നു. Tl(I) സള്ഫൈഡ് ലായനിയില്നിന്ന് അവക്ഷേപിക്കാനാവും. ഇത് തന്മാത്രീയ ഓക്സിജനുമായി Tl2SO2 രൂപീകരിക്കും.
Tl(III) ലായനിയിലേക്ക് ഒരു ക്ഷാരം ചേര്ക്കുമ്പോള് ഥാലിയം ട്രൈ ഓക്സൈഡ് (Tl2O3) തവിട്ടുനിറത്തിലുള്ള അവക്ഷിപ്തമായി വേര്തിരിയുന്നു. 100o-ല് Tl(III) ഓക്സൈഡ് Tl(I) ഓക്സൈഡായി മാറുന്നു. Tl(III) ഹൈഡ്രോക്സൈഡ് രൂപീകൃതമാകാറില്ല. Tl(I) ഹാലൈഡുകള് സ്വതന്ത്ര ഹാലജനുമായി ചേര്ന്ന് Tl(III) ഹാലൈഡുകള് രൂപീകരിക്കുമെങ്കിലും ഇവ താപീയമായി അസ്ഥിരമാണ്. Tl(III) ഫ്ളൂറൈഡ്, ഫ്ളൂറിനടങ്ങുന്ന അന്തരീക്ഷത്തില് 550oC-ല് ഉരുകുന്നു. എന്നാല്, വായുവിന്റെ സാന്നിധ്യത്തില് വീണ്ടും ചൂടാക്കുമ്പോള് വിഘടിക്കുകയും ജലത്തില് അപഘടനത്തിനു വിധേയമാവുകയും ചെയ്യുന്നു. ഥാലിയം ട്രൈ ക്ലോറൈഡ് (TlCl3) ആകട്ടെ, 25oC-ല് ഉരുകുന്നതിനോടൊപ്പം വിഘടിക്കുകയും ചെയ്യുന്നു.
R3Tl,R2Tl X,RTIX2 എന്നീ വിഭാഗത്തിലുള്ള ജൈവലോഹസംയുക്തങ്ങള് രൂപീകരിക്കാറുണ്ട്. R-ആല് ക്കൈല് അല്ലെങ്കില് അരൈല് ഗ്രൂപ്പുകളും X-ഹാലജനുമാണ്. R2TlX എന്ന വിഭാഗത്തില് പ്പെടുന്ന ജൈവലോഹസംയുക്തങ്ങള് വളരെ സ്ഥിരതയുള്ളവയായിരിക്കും. വായുവിലെ ഓക്സിജനുമായോ ഈര്പ്പവുമായോ ഇവ പ്രതിപ്രവര്ത്തിക്കുന്നില്ല. ട്രൈ ആല്ക്കൈല് സംയുക്തങ്ങള് (R3Tl) കൂടുതല് പ്രതിക്രിയാക്ഷമമാണ്. ഉദാഹരണത്തിന് ട്രൈ ഈഥൈല് ഥാലിയം 55oC-ല് തിളയ്ക്കുകയും 130oC-ല് വിഘടിക്കുകയും ചെയ്യുന്ന ദ്രാവകമാണ്.
സൈക്ലോപെന്റാ ഡൈഈന് ബാഷ്പം ഥാലിയം (I) ഹൈഡ്രോക്സൈഡിന്റെ ജലീയ ലായനിയിലൂടെ കടത്തിവിടുന്നതുവഴി TlC5H5 എന്ന സംയുക്തം സംശ്ലേഷണം ചെയ്യാനാവും. ഈ സംയുക്തം ബാഷ്പാവസ്ഥയില് ഏകകമായും (monomer) ഖരാവസ്ഥയില് ബഹുലകമായും (polymer) സ്ഥിതിചെയ്യുന്നു. ലോഹഥാലിയം ആല്ക്കഹോളില് ലയിക്കുമ്പോള് നാല് ആല് ക്കോക്സൈഡ് അടങ്ങുന്ന സംയുക്തം [Tl4(OR)4] ഉണ്ടാകുന്നു. ടെട്രാഹിഡ്രന്റെ നാലുമൂലകളിലും ഥാലിയവും ഓരോ വശത്തിനും ലംബമായി -OCH3 ഗ്രൂപ്പും സ്ഥിതിചെയ്യുന്നു.
സ്പെക്ട്രോസ്കോപ്പി, ഓക്സൈഡിമെട്രി എന്നീ വിശ്ലേഷണോപാധികളാണ് ഥാലിയം നിര്ണയനത്തിനുപയോഗിക്കുന്നത്. ലായനിയിലുള്ള ഥാലിയം നിര്ണയിക്കുവാന് ഓക്സൈഡിമെട്രി ഉപയോഗപ്രദമാണ്.Tl2O3 എന്ന ഓക്സൈഡ് അവക്ഷേപിപ്പിച്ച് ഉണക്കിയെടുത്ത് ഭാരമാപനംവഴി ഥാലിയം നിര്ണയിക്കാനാവും.
ഉപയോഗങ്ങള്. ഇലക്ട്രോണിക് വ്യവസായങ്ങളില് ഥാലിയം അലോയ്കളുടെ ഉപയോഗം പ്രാധാന്യമര്ഹിക്കുന്നു. ഥാലിയം കൊണ്ട് പ്രവര്ത്തനക്ഷമമാക്കിയ സോഡിയം അയഡൈഡ് പരലുകള് പ്രകാശസംവര്ധക (photomultiplier) ട്യൂബുകളില് ഉപയോഗിച്ചുവരുന്നു. സാധാരണ ഉപയോഗിച്ചുവരുന്ന മെര്ക്കുറി സ്വിച്ചുകള്ക്കും സീലുകള്ക്കും പകരമായി വളരെ താഴ്ന്ന താപനിലയിലും പ്രവര്ത്തിക്കുവാന് കഴിവുള്ള ഥാലിയം മെര്ക്കുറി അലോയ്കൊണ്ടുള്ള സ്വിച്ചുകള് ധ്രുവപ്രദേശങ്ങളിലും ഫലപ്രദമായി ഉപയോഗിക്കാന് കഴിയും. ഇന്ഫ്രാറെഡ് സംവേദനക്ഷമമായ പ്രകാശവൈദ്യുത സെല്ലുകളില് ഥാലസ് സള്ഫൈഡ് ഉപയോഗിക്കുന്നു. മനുഷ്യനും മറ്റു ജീവജാലങ്ങള്ക്കും ഥാലിയം സംയുക്തങ്ങള് വിഷമായി ഭവിക്കാറുണ്ട്. എലിവിഷമായി ഥാലിയം വ്യാപകമായി ഉപയോഗിച്ചുവരുന്നു. സ്വകാര്യ ഉപയോഗങ്ങള്ക്ക് ഥാലിയം ഉപയോഗിക്കുന്നത് ഇന്ന് നിയമവിരുദ്ധമാണ്. ഥാലസ് ലവണങ്ങള് പൂപ്പല്നാശിനി, അണുനാശിനി എന്നീ നിലകളില് ഉപയോഗിച്ചുവരുന്നുണ്ട്.