This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
Mksol (സംവാദം | സംഭാവനകള്) (→ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ്) |
Mksol (സംവാദം | സംഭാവനകള്) (→ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ്) |
||
| (ഇടക്കുള്ള 3 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 2: | വരി 2: | ||
ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് (Inductive effect) തന്മാത്രയുടെ നിമ്നതമാവസ്ഥയിലുള്ള (ground state) സ്ഥിരമായ ധ്രൂവീകരണം. ഇലക്ട്രാനെഗറ്റീവതയിൽ വ്യത്യാസമുള്ള രണ്ടു ആറ്റങ്ങള് തമ്മിൽ സഹസംയോജകബന്ധത്തിൽ ഏർപ്പെടുമ്പോള് അവയ്ക്കിടയിലെ ബന്ധന ഇലക്ട്രാണ് ജോടി, രണ്ടാറ്റങ്ങളും തുല്യമായിട്ടല്ല പങ്കിടുന്നത്. അത് ഇലക്ട്രാനെഗറ്റീവത കൂടുതലുള്ള ആറ്റത്തിലേക്ക് അല്പം വിസ്ഥാപിത(shifted)മായിരിക്കും. ആകയാൽ പ്രസ്തുത ആറ്റത്തിൽ ഇലക്ട്രാണ്-സാന്ദ്രത അധികമായിത്തീരുന്നു. ഇപ്രകാരം രണ്ടാറ്റങ്ങള്ക്കുമിടയിൽ ഒരു ചാർജ് വ്യത്യാസം ഉടലെടുക്കുന്നു. ഇലക്ട്രാനെഗറ്റീവത കൂടിയ ആറ്റത്തിന് ആംശികമായ ഋണചാർജും ഇലക്ട്രാനെഗറ്റീവത കുറഞ്ഞ ആറ്റത്തിന് ധനചാർജും ലഭിക്കുന്നു. ഇത്തരത്തിലുള്ള ചാർജ് വ്യതിയാനം δ+,δ- കൊണ്ടോ, →- കൊണ്ടോ പ്രതിനിധികരിക്കാം. ഉദാഹരണമായി ആൽക്കൈൽ ഹാലൈഡുകളിൽ ഹാലൊജന് ആറ്റങ്ങള് കാർബണിനെക്കാള് കൂടുതൽ വിദ്യുത്-ഋണങ്ങളാകയാൽ ഹാലൊജന് ആറ്റങ്ങള് ഇലക്ട്രാണുകളെ അല്പം അടുപ്പിക്കുന്നു: | ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് (Inductive effect) തന്മാത്രയുടെ നിമ്നതമാവസ്ഥയിലുള്ള (ground state) സ്ഥിരമായ ധ്രൂവീകരണം. ഇലക്ട്രാനെഗറ്റീവതയിൽ വ്യത്യാസമുള്ള രണ്ടു ആറ്റങ്ങള് തമ്മിൽ സഹസംയോജകബന്ധത്തിൽ ഏർപ്പെടുമ്പോള് അവയ്ക്കിടയിലെ ബന്ധന ഇലക്ട്രാണ് ജോടി, രണ്ടാറ്റങ്ങളും തുല്യമായിട്ടല്ല പങ്കിടുന്നത്. അത് ഇലക്ട്രാനെഗറ്റീവത കൂടുതലുള്ള ആറ്റത്തിലേക്ക് അല്പം വിസ്ഥാപിത(shifted)മായിരിക്കും. ആകയാൽ പ്രസ്തുത ആറ്റത്തിൽ ഇലക്ട്രാണ്-സാന്ദ്രത അധികമായിത്തീരുന്നു. ഇപ്രകാരം രണ്ടാറ്റങ്ങള്ക്കുമിടയിൽ ഒരു ചാർജ് വ്യത്യാസം ഉടലെടുക്കുന്നു. ഇലക്ട്രാനെഗറ്റീവത കൂടിയ ആറ്റത്തിന് ആംശികമായ ഋണചാർജും ഇലക്ട്രാനെഗറ്റീവത കുറഞ്ഞ ആറ്റത്തിന് ധനചാർജും ലഭിക്കുന്നു. ഇത്തരത്തിലുള്ള ചാർജ് വ്യതിയാനം δ+,δ- കൊണ്ടോ, →- കൊണ്ടോ പ്രതിനിധികരിക്കാം. ഉദാഹരണമായി ആൽക്കൈൽ ഹാലൈഡുകളിൽ ഹാലൊജന് ആറ്റങ്ങള് കാർബണിനെക്കാള് കൂടുതൽ വിദ്യുത്-ഋണങ്ങളാകയാൽ ഹാലൊജന് ആറ്റങ്ങള് ഇലക്ട്രാണുകളെ അല്പം അടുപ്പിക്കുന്നു: | ||
| + | |||
| + | [[ചിത്രം:Vol3a_688_Formula_2.jpg|300px]] | ||
ഹാലൊജന്-ആറ്റത്തിലേക്കു തൊടുക്കപ്പെട്ട കാർബണ്-ആറ്റം, മറ്റു കാർബണ്-ആറ്റങ്ങളോടു ബന്ധിക്കപ്പെട്ടിരുന്നാൽ, ഈ ഇലക്ട്രാണ്-ആകർഷണത്തിന്റെ പ്രഭാവം കാർബണ് ശൃംഖലയിലൂടെ മറ്റു കാർബണ് ആറ്റങ്ങളിലേക്കും വ്യാപിക്കും. അതായത് ഹാലൊജന് നേരിട്ട് ആകർഷിക്കുന്ന കാർബണ്-ആറ്റത്തിൽ മാത്രമല്ല അതിനോടു തൊടുക്കപ്പെട്ട കാർബണ്-ശൃംഖലയിലെ ഓരോ ആറ്റത്തിലും ഇലക്ട്രാണ്-പോരായ്മ അനുഭവപ്പെടുന്നതാണ്. | ഹാലൊജന്-ആറ്റത്തിലേക്കു തൊടുക്കപ്പെട്ട കാർബണ്-ആറ്റം, മറ്റു കാർബണ്-ആറ്റങ്ങളോടു ബന്ധിക്കപ്പെട്ടിരുന്നാൽ, ഈ ഇലക്ട്രാണ്-ആകർഷണത്തിന്റെ പ്രഭാവം കാർബണ് ശൃംഖലയിലൂടെ മറ്റു കാർബണ് ആറ്റങ്ങളിലേക്കും വ്യാപിക്കും. അതായത് ഹാലൊജന് നേരിട്ട് ആകർഷിക്കുന്ന കാർബണ്-ആറ്റത്തിൽ മാത്രമല്ല അതിനോടു തൊടുക്കപ്പെട്ട കാർബണ്-ശൃംഖലയിലെ ഓരോ ആറ്റത്തിലും ഇലക്ട്രാണ്-പോരായ്മ അനുഭവപ്പെടുന്നതാണ്. | ||
| + | [[ചിത്രം:Vol3a_688_Formula_1.jpg|300px]] | ||
| - | Cl ആറ്റത്തിന്റെ ഇലക്ട്രാണ്-ആസക്തിയാൽ Cl ആണ് | + | Cl ആറ്റത്തിന്റെ ഇലക്ട്രാണ്-ആസക്തിയാൽ Cl ആണ് C<sub>1</sub> -Cl ബന്ധത്തിലെ (bond) ഇലക്ട്രാണുകള് ഇ1നെക്കാള് കൂടുതലായി അനുഭവിക്കുന്നത്. തന്മൂലം C<sub>1</sub>-ന് ഇലക്ട്രാണ്-പോരായ്മയുണ്ടാകുന്നു. അതു പരിഹരിക്കാനായി C<sub>2</sub>-C<sub>1</sub> ബന്ധത്തിലെ ഇലക്ട്രാണുകളെ അല്പം ആകർഷിക്കുന്നു. തുടർന്നു ശൃംഖലയുടെ മറ്റേ അഗ്രംവരെ ഈ ഇലക്ട്രാണ്-ആകർഷണം ഉണ്ടാകുന്നു. തന്മാത്രയുടെ ഇഹ-അഗ്രം തന്മൂലം ആംശികമായി ഋണചാർജും മറ്റേ അഗ്രം തത്തുല്യമായ ധനചാർജും സ്വീകരിക്കുന്നു. അതായത് തന്മാത്രയുടെ ധ്രുവീകരണം സ്ഥിരമായിത്തീരുന്നു. എന്നാൽ ഈ ഇലക്ട്രാണ്-പോരായ്മ Cl-ൽ നിന്നു വളരെ അകലത്തിൽ അനുഭവപ്പെടുന്നില്ല. മൂലസ്ഥാനത്തുനിന്ന് അകലുന്തോറും ഈ പ്രഭാവത്തിന് ശക്തി കുറഞ്ഞുവരുന്നതായി കാണാം. ഹൈഡ്രജനേക്കാള് ഇലക്ട്രാണ് ആകർഷണ ശക്തികൂടുതലുള്ള ആറ്റങ്ങളും ഗ്രൂപ്പുകളും നെഗറ്റീവ് ഇന്ഡക്റ്റീവ് ഇഫക്റ്റും (-I effect) ഇലക്ട്രാണ് ആകർഷണശക്തി ഹൈഡ്രജനേക്കാള് കുറവുള്ളവ പോസിറ്റീവ് ഇന്ഡക്റ്റീവ് ഇഫക്റ്റും (+I effect) പ്രദർശിപ്പിക്കുന്നു. |
-I പ്രഭാവമുള്ള ഗ്രൂപ്പുകള്/ആറ്റങ്ങള് (ആരോഹണക്രമത്തിൽ) | -I പ്രഭാവമുള്ള ഗ്രൂപ്പുകള്/ആറ്റങ്ങള് (ആരോഹണക്രമത്തിൽ) | ||
| - | + | -OCH<sub>3</sub>, I, Br, Cl, F, -NO<sub>2</sub>, N+(CH<sub>3</sub>)3 | |
+ I പ്രഭാവമുള്ള ഗ്രൂപ്പുകള്/ആറ്റങ്ങള് (ആരോഹണക്രമത്തിൽ) | + I പ്രഭാവമുള്ള ഗ്രൂപ്പുകള്/ആറ്റങ്ങള് (ആരോഹണക്രമത്തിൽ) | ||
| - | + | CH<sub>3</sub>-, CH<sub>3</sub>-CH<sub>2</sub>-, (CH<sub>3</sub>)2 CH-, (CH<sub>3</sub>)3 C-, -COO-, | |
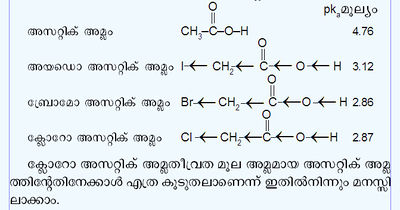
| - | ഡൈപോള്മൊമന്റ്, ബന്ധനനീളം (bond length) എന്നീ ഭൗതികഗുണ ധർമങ്ങളിലും അമ്ലങ്ങളുടെയും ക്ഷാരങ്ങളുടെയും തീവ്രതയിലും ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് വ്യക്തമായ സ്വാധീനം ചെലുത്തുന്നു. ഹാലൊജനുകളുടെ -I ഇഫക്റ്റുമൂലം ഹാലൊജന് പ്രതിസ്ഥാപിത അമ്ലങ്ങളുടെ തീവ്രത, മൂല അമ്ലത്തിനേക്കാള് കൂടുതലായിരിക്കും. അസറ്റിക് അമ്ലത്തിന്റെയും ഹാലൊജന് പ്രതിസ്ഥാപിത അസറ്റിക് അമ്ലങ്ങളുടെയും | + | ഡൈപോള്മൊമന്റ്, ബന്ധനനീളം (bond length) എന്നീ ഭൗതികഗുണ ധർമങ്ങളിലും അമ്ലങ്ങളുടെയും ക്ഷാരങ്ങളുടെയും തീവ്രതയിലും ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് വ്യക്തമായ സ്വാധീനം ചെലുത്തുന്നു. ഹാലൊജനുകളുടെ -I ഇഫക്റ്റുമൂലം ഹാലൊജന് പ്രതിസ്ഥാപിത അമ്ലങ്ങളുടെ തീവ്രത, മൂല അമ്ലത്തിനേക്കാള് കൂടുതലായിരിക്കും. അസറ്റിക് അമ്ലത്തിന്റെയും ഹാലൊജന് പ്രതിസ്ഥാപിത അസറ്റിക് അമ്ലങ്ങളുടെയും pk<sub>a</sub> മൂല്യം ചുവടെ കൊടുക്കുന്നു. |
| - | ( | + | (pk<sub>a</sub>മൂല്യം കുറയുന്നതിനനുസരിച്ച് അമ്ല തീവ്രത കൂടുന്നു.) |
| - | + | [[ചിത്രം:Vol3a_689_1_formula.jpg|400px]] | |
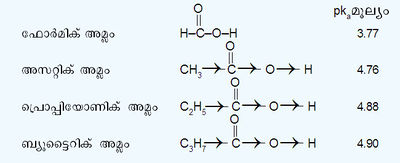
| - | + | ഇലക്ട്രാണ് പ്രദാന സ്വഭാവമുള്ള ആൽക്കൈൽ ഗ്രൂപ്പുകള് (+I ഇഫക്റ്റ്) വർധിക്കുന്തോറും അമ്ലതീവ്രത കുറയുന്നു. ഫോർമിക് അമ്ലത്തിൽനിന്നും ബ്യൂട്ടൈറിക് അമ്ലത്തിലെത്തുമ്പോഴേക്കും ഉണ്ടാകുന്ന അമ്ലതീവ്രതയുടെ വ്യതിയാനത്തിൽനിന്നും ഇത് പ്രകടമാണ്. | |
| - | + | [[ചിത്രം:vol_3_page-689_pk-value-377.jpg|400px]] | |
| - | + | നേരെ മറിച്ച്, ആൽക്കൈൽ ഗ്രൂപ്പുകളുടെ (+I effect) സോന്നിധ്യം ക്ഷാരഗുണം വർധിപ്പിക്കുന്നു. അതിനാൽ അമോണിയ(NH3)യേക്കാള് ക്ഷാരത കൂടുതൽ അമീനുകള്(R-NH2)ക്കായിരിക്കും. ക്ഷാരഗുണത്തിന്റെ ആരോഹണക്രമത്തിൽ അമോണിയയെയും അമീനുകളെയും ഇപ്രകാരം എഴുതാം. | |
| - | + | [[ചിത്രം:Vol3a_689_2_formula.jpg|400px]] | |
| - | + | മിസൊമെറിക് ഇഫക്റ്റ്. അപൂരിതയൗഗികങ്ങളിൽ, പ്രത്യേകിച്ച് സംയുഗ്മിതവ്യൂഹങ്ങളിൽ (conjugated systems)ഉണ്ടാകാവുന്ന പൈ ഇലക്ട്രാണ്-വിസ്ഥാപനത്തിന് മിസൊമെറിക് ഇഫക്റ്റ് (mesomeric effect)എന്നു പറയുന്നു. ഇലക്ട്രാണ്-ആസക്തി കൂടുതലുള്ള ആറ്റത്തിലേക്ക് പൈ-ബന്ധത്തിലെ ഇലക്ട്രാണുകള് നീക്കപ്പെട്ടിരിക്കും. ഉദാഹരണമായി കാർബൊണൈൽ-ഗ്രൂപ്പിൽ (> C = O) ഓക്സിജന് ഋണചാർജും കാർബണിന് ധനചാർജും ആംശികമായി കൈവരുന്നുണ്ടെന്നു കരുതേണ്ടിയിരിക്കുന്നു. കാർബൊണൈൽ യൗഗികങ്ങളുടെ (ഉദാ. ആൽഡിഹൈഡുകള്; കീറ്റോണുകള്) രാസപ്രവർത്തനങ്ങള് വ്യാഖ്യാനിക്കുന്നതിന് ഈ ധ്രൂവീകരണം സങ്കല്പിക്കേണ്ടതായിവരും. കാർബൊണൈൽ ഗ്രൂപ്പിന്റെ സംരചന താഴെ പറയുന്ന രണ്ട് അഗ്രസ്ഥ-സംരചനകളുടെ (extreme structures) അനുനാദം (resonance) കൊണ്ടാണ് ചിത്രീകരിക്കപ്പെടുന്നത്: | |
| - | + | [[ചിത്രം:Vol3a_689_3_formula.jpg|400px]] | |
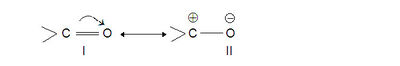
| - | + | അതായത് സഹസംയോജകസംരചനയായ I-നും അയോണികസംരചനയായ II-നും ഇടയിലുള്ള ഒന്നാണ് യഥാർഥസംരചന. I-ൽ ക്കാണുന്ന വളഞ്ഞ ശരചിഹ്നം പൈ-ഇലക്ട്രാണുകളുടെ ഓക്സിജനിലേക്കുള്ള നീക്കത്തെ കുറിക്കുന്നു. ഇത്തരം ഗ്രൂപ്പ് ഒരു >C=C< ബന്ധവുമായി സംയുഗ്മിതമാകുമ്പോള്, >C=O ഗ്രൂപ്പിന്റെ മേൽവിവരിച്ച ധ്രുവീകരണംഇലക്ട്രാണുകളിൽക്കൂടി കൂടുതൽ പ്രക്ഷേപിതമാകുന്നു. ആംശികധനചാർജ് > C = O ഗ്രൂപ്പിലെ C-ൽനിന്ന് മറ്റൊന്നിലേക്കു നീക്കപ്പെടുന്നു: | |
| - | + | [[ചിത്രം:Vol3a_689_4_formula.jpg|400px]] | |
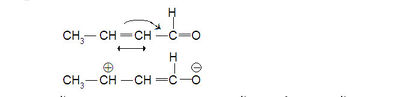
| - | + | അതായത് C1- നോടൊപ്പം C3-യും ഇലക്ട്രാണ് പോരായ്മ അനുഭവിക്കുന്നു. സംയുഗ്മിതമായ ദ്വിബന്ധങ്ങള് ഇനിയുമുണ്ടെങ്കിൽ ഒന്നിടവിട്ട് C-ആറ്റങ്ങളിലെല്ലാംതന്നെ ഇലക്ട്രാണ്-പോരായ്മ സംജാതമാകുന്നു. പൂരിതവ്യൂഹങ്ങളിലെ (saturated systems) ഇെന്ഡക്റ്റീവ് ഇഫക്റ്റ് മൂലസ്ഥാനത്തുനിന്ന് അകലുന്തോറും ക്ഷയിച്ചുവരുന്നു; എന്നാൽ സംയുഗ്മിതവ്യൂഹത്തിൽ കൂടിയുള്ള മിസൊമെറിക് ഇഫക്റ്റിന് ക്ഷയംവരുന്നില്ല. ബെന്സീന്-വ്യുത്പന്നങ്ങളിൽ മിസൊമെറിക് ഇഫക്റ്റ് വ്യക്തമായി കാണാം. ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ്പോലെ മിസൊമെറിക് ഇഫക്റ്റും തന്മാത്രയുടെ നിമ്നതമാവസ്ഥയിലുള്ള സ്ഥിരമായ ധ്രുവീകരണമായതിനാൽ അവ ഏതു യൗഗികത്തിലുണ്ടോ അതിന്റെ ഭൗതികഗുണധർമങ്ങളിൽ പ്രതിഫലിക്കുന്നു. ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് മുഖ്യമായും പൂരിതഗ്രൂപ്പുകളിലും പൂരിതതന്മാത്രകളിലും കാണപ്പെടുമ്പോള് മിസൊമെറിക് ഇഫക്റ്റ് അപൂരിതയൗഗികങ്ങളിൽ, വിശിഷ്യ സംയുഗ്മിതവ്യൂഹങ്ങളിൽ കാണപ്പെടുന്നു. ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് സിഗ്മാ-ബന്ധങ്ങളിലെ ഇലക്ട്രാണുകളെ സംബന്ധിക്കുന്ന ഒന്നാണ്; മിസൊമെറിക് ഇഫക്റ്റ് പൈ-ബന്ധങ്ങളിലെ ഇലക്ട്രാണുകളെ സംബന്ധിക്കുന്നതും. ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് പൂരിതശൃംഖലയിൽ അല്പദൂരം മാത്രം അനുഭവപ്പെടുന്നു. മിസൊമെറിക് ഇഫക്റ്റ് ആകട്ടെ സംയുഗ്മിതവ്യൂഹമുണ്ടെങ്കിൽ വലിയ തന്മാത്രകളിൽപ്പോലും ഉടനീളം പ്രക്ഷേപിതമായിക്കാണുന്നു. | |
ഇന്ഡക്റ്റൊമെറിക്-ഇലക്ട്രാമെറിക് ഇഫക്റ്റുകള്. ഒരു പ്രതിപ്രവർത്തകത്തിന്റെ സാമീപ്യത്താൽ തന്മാത്രയിൽ ഇലക്ട്രാണ്-വിതരണമാറ്റങ്ങള് ഉണ്ടാവുന്നതാണ്-പ്രത്യേകിച്ച് സംക്രമണാവസ്ഥയിൽ (transition state). എന്നാൽ ഈ ഇഫക്റ്റുകള് താത്കാലികങ്ങളായിരിക്കും. പ്രതിപ്രവർത്തകത്തിന്റെ സാമീപ്യം ഇല്ലാതായാൽ ഇഫക്റ്റും ഇല്ലാതാവും; തന്മാത്ര അതിന്റെ പൂർവാവസ്ഥയിലേക്കു പോവുകയും ചെയ്യും. തന്മൂലം പ്രതിപ്രവർത്തനവേളയിലനുഭവപ്പെടുന്ന ഈ ഇഫക്റ്റുകള് തന്മാത്രയുടെ സ്വതവേയുള്ള ഗുണധർമങ്ങളെ സ്വാധീനിക്കുന്നില്ല; പ്രതിപ്രവർത്തനത്തിന്റെ ഗതിയെ സ്വാധീനിക്കുന്നു എന്നുമാത്രം. ഇവിടെ ഇഫക്റ്റ് പ്രക്ഷേപിതമാകുന്നത് ഇന്ഡക്റ്റീവ് രീതിയിലോ മിസൊമെറിക് രീതിയിലോ ആകാം. ഇപ്രകാരം സംഭവിക്കുന്ന പ്രഭാവങ്ങള്ക്കാണ് യഥാക്രമം ഇന്ഡക്റ്റൊമെറിക് ഇഫക്റ്റ് എന്നും ഇലക്ട്രാമെറിക് ഇഫക്റ്റ് എന്നും പറയപ്പെടുന്നത്. 1947-ൽ രസതന്ത്രത്തിന് നോബൽസമ്മാനം ലഭിച്ച റോബർട് റോബിന്സണും ഇന്ഗോള്ഡ്, ലാപ്വർഥ് എന്നീ പ്രസിദ്ധവൈജ്ഞാനികരുമാണ് ഇതിനെപ്പറ്റി വിശദമായി പഠനം നടത്തിയത്. | ഇന്ഡക്റ്റൊമെറിക്-ഇലക്ട്രാമെറിക് ഇഫക്റ്റുകള്. ഒരു പ്രതിപ്രവർത്തകത്തിന്റെ സാമീപ്യത്താൽ തന്മാത്രയിൽ ഇലക്ട്രാണ്-വിതരണമാറ്റങ്ങള് ഉണ്ടാവുന്നതാണ്-പ്രത്യേകിച്ച് സംക്രമണാവസ്ഥയിൽ (transition state). എന്നാൽ ഈ ഇഫക്റ്റുകള് താത്കാലികങ്ങളായിരിക്കും. പ്രതിപ്രവർത്തകത്തിന്റെ സാമീപ്യം ഇല്ലാതായാൽ ഇഫക്റ്റും ഇല്ലാതാവും; തന്മാത്ര അതിന്റെ പൂർവാവസ്ഥയിലേക്കു പോവുകയും ചെയ്യും. തന്മൂലം പ്രതിപ്രവർത്തനവേളയിലനുഭവപ്പെടുന്ന ഈ ഇഫക്റ്റുകള് തന്മാത്രയുടെ സ്വതവേയുള്ള ഗുണധർമങ്ങളെ സ്വാധീനിക്കുന്നില്ല; പ്രതിപ്രവർത്തനത്തിന്റെ ഗതിയെ സ്വാധീനിക്കുന്നു എന്നുമാത്രം. ഇവിടെ ഇഫക്റ്റ് പ്രക്ഷേപിതമാകുന്നത് ഇന്ഡക്റ്റീവ് രീതിയിലോ മിസൊമെറിക് രീതിയിലോ ആകാം. ഇപ്രകാരം സംഭവിക്കുന്ന പ്രഭാവങ്ങള്ക്കാണ് യഥാക്രമം ഇന്ഡക്റ്റൊമെറിക് ഇഫക്റ്റ് എന്നും ഇലക്ട്രാമെറിക് ഇഫക്റ്റ് എന്നും പറയപ്പെടുന്നത്. 1947-ൽ രസതന്ത്രത്തിന് നോബൽസമ്മാനം ലഭിച്ച റോബർട് റോബിന്സണും ഇന്ഗോള്ഡ്, ലാപ്വർഥ് എന്നീ പ്രസിദ്ധവൈജ്ഞാനികരുമാണ് ഇതിനെപ്പറ്റി വിശദമായി പഠനം നടത്തിയത്. | ||
(ഡോ.കെ.പി. ധർമരാജയ്യർ) | (ഡോ.കെ.പി. ധർമരാജയ്യർ) | ||
Current revision as of 04:48, 8 ജൂലൈ 2014
ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ്
ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് (Inductive effect) തന്മാത്രയുടെ നിമ്നതമാവസ്ഥയിലുള്ള (ground state) സ്ഥിരമായ ധ്രൂവീകരണം. ഇലക്ട്രാനെഗറ്റീവതയിൽ വ്യത്യാസമുള്ള രണ്ടു ആറ്റങ്ങള് തമ്മിൽ സഹസംയോജകബന്ധത്തിൽ ഏർപ്പെടുമ്പോള് അവയ്ക്കിടയിലെ ബന്ധന ഇലക്ട്രാണ് ജോടി, രണ്ടാറ്റങ്ങളും തുല്യമായിട്ടല്ല പങ്കിടുന്നത്. അത് ഇലക്ട്രാനെഗറ്റീവത കൂടുതലുള്ള ആറ്റത്തിലേക്ക് അല്പം വിസ്ഥാപിത(shifted)മായിരിക്കും. ആകയാൽ പ്രസ്തുത ആറ്റത്തിൽ ഇലക്ട്രാണ്-സാന്ദ്രത അധികമായിത്തീരുന്നു. ഇപ്രകാരം രണ്ടാറ്റങ്ങള്ക്കുമിടയിൽ ഒരു ചാർജ് വ്യത്യാസം ഉടലെടുക്കുന്നു. ഇലക്ട്രാനെഗറ്റീവത കൂടിയ ആറ്റത്തിന് ആംശികമായ ഋണചാർജും ഇലക്ട്രാനെഗറ്റീവത കുറഞ്ഞ ആറ്റത്തിന് ധനചാർജും ലഭിക്കുന്നു. ഇത്തരത്തിലുള്ള ചാർജ് വ്യതിയാനം δ+,δ- കൊണ്ടോ, →- കൊണ്ടോ പ്രതിനിധികരിക്കാം. ഉദാഹരണമായി ആൽക്കൈൽ ഹാലൈഡുകളിൽ ഹാലൊജന് ആറ്റങ്ങള് കാർബണിനെക്കാള് കൂടുതൽ വിദ്യുത്-ഋണങ്ങളാകയാൽ ഹാലൊജന് ആറ്റങ്ങള് ഇലക്ട്രാണുകളെ അല്പം അടുപ്പിക്കുന്നു:
ഹാലൊജന്-ആറ്റത്തിലേക്കു തൊടുക്കപ്പെട്ട കാർബണ്-ആറ്റം, മറ്റു കാർബണ്-ആറ്റങ്ങളോടു ബന്ധിക്കപ്പെട്ടിരുന്നാൽ, ഈ ഇലക്ട്രാണ്-ആകർഷണത്തിന്റെ പ്രഭാവം കാർബണ് ശൃംഖലയിലൂടെ മറ്റു കാർബണ് ആറ്റങ്ങളിലേക്കും വ്യാപിക്കും. അതായത് ഹാലൊജന് നേരിട്ട് ആകർഷിക്കുന്ന കാർബണ്-ആറ്റത്തിൽ മാത്രമല്ല അതിനോടു തൊടുക്കപ്പെട്ട കാർബണ്-ശൃംഖലയിലെ ഓരോ ആറ്റത്തിലും ഇലക്ട്രാണ്-പോരായ്മ അനുഭവപ്പെടുന്നതാണ്.
Cl ആറ്റത്തിന്റെ ഇലക്ട്രാണ്-ആസക്തിയാൽ Cl ആണ് C1 -Cl ബന്ധത്തിലെ (bond) ഇലക്ട്രാണുകള് ഇ1നെക്കാള് കൂടുതലായി അനുഭവിക്കുന്നത്. തന്മൂലം C1-ന് ഇലക്ട്രാണ്-പോരായ്മയുണ്ടാകുന്നു. അതു പരിഹരിക്കാനായി C2-C1 ബന്ധത്തിലെ ഇലക്ട്രാണുകളെ അല്പം ആകർഷിക്കുന്നു. തുടർന്നു ശൃംഖലയുടെ മറ്റേ അഗ്രംവരെ ഈ ഇലക്ട്രാണ്-ആകർഷണം ഉണ്ടാകുന്നു. തന്മാത്രയുടെ ഇഹ-അഗ്രം തന്മൂലം ആംശികമായി ഋണചാർജും മറ്റേ അഗ്രം തത്തുല്യമായ ധനചാർജും സ്വീകരിക്കുന്നു. അതായത് തന്മാത്രയുടെ ധ്രുവീകരണം സ്ഥിരമായിത്തീരുന്നു. എന്നാൽ ഈ ഇലക്ട്രാണ്-പോരായ്മ Cl-ൽ നിന്നു വളരെ അകലത്തിൽ അനുഭവപ്പെടുന്നില്ല. മൂലസ്ഥാനത്തുനിന്ന് അകലുന്തോറും ഈ പ്രഭാവത്തിന് ശക്തി കുറഞ്ഞുവരുന്നതായി കാണാം. ഹൈഡ്രജനേക്കാള് ഇലക്ട്രാണ് ആകർഷണ ശക്തികൂടുതലുള്ള ആറ്റങ്ങളും ഗ്രൂപ്പുകളും നെഗറ്റീവ് ഇന്ഡക്റ്റീവ് ഇഫക്റ്റും (-I effect) ഇലക്ട്രാണ് ആകർഷണശക്തി ഹൈഡ്രജനേക്കാള് കുറവുള്ളവ പോസിറ്റീവ് ഇന്ഡക്റ്റീവ് ഇഫക്റ്റും (+I effect) പ്രദർശിപ്പിക്കുന്നു.
-I പ്രഭാവമുള്ള ഗ്രൂപ്പുകള്/ആറ്റങ്ങള് (ആരോഹണക്രമത്തിൽ)
-OCH3, I, Br, Cl, F, -NO2, N+(CH3)3
+ I പ്രഭാവമുള്ള ഗ്രൂപ്പുകള്/ആറ്റങ്ങള് (ആരോഹണക്രമത്തിൽ)
CH3-, CH3-CH2-, (CH3)2 CH-, (CH3)3 C-, -COO-,
ഡൈപോള്മൊമന്റ്, ബന്ധനനീളം (bond length) എന്നീ ഭൗതികഗുണ ധർമങ്ങളിലും അമ്ലങ്ങളുടെയും ക്ഷാരങ്ങളുടെയും തീവ്രതയിലും ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് വ്യക്തമായ സ്വാധീനം ചെലുത്തുന്നു. ഹാലൊജനുകളുടെ -I ഇഫക്റ്റുമൂലം ഹാലൊജന് പ്രതിസ്ഥാപിത അമ്ലങ്ങളുടെ തീവ്രത, മൂല അമ്ലത്തിനേക്കാള് കൂടുതലായിരിക്കും. അസറ്റിക് അമ്ലത്തിന്റെയും ഹാലൊജന് പ്രതിസ്ഥാപിത അസറ്റിക് അമ്ലങ്ങളുടെയും pka മൂല്യം ചുവടെ കൊടുക്കുന്നു.
(pkaമൂല്യം കുറയുന്നതിനനുസരിച്ച് അമ്ല തീവ്രത കൂടുന്നു.)
ഇലക്ട്രാണ് പ്രദാന സ്വഭാവമുള്ള ആൽക്കൈൽ ഗ്രൂപ്പുകള് (+I ഇഫക്റ്റ്) വർധിക്കുന്തോറും അമ്ലതീവ്രത കുറയുന്നു. ഫോർമിക് അമ്ലത്തിൽനിന്നും ബ്യൂട്ടൈറിക് അമ്ലത്തിലെത്തുമ്പോഴേക്കും ഉണ്ടാകുന്ന അമ്ലതീവ്രതയുടെ വ്യതിയാനത്തിൽനിന്നും ഇത് പ്രകടമാണ്.
നേരെ മറിച്ച്, ആൽക്കൈൽ ഗ്രൂപ്പുകളുടെ (+I effect) സോന്നിധ്യം ക്ഷാരഗുണം വർധിപ്പിക്കുന്നു. അതിനാൽ അമോണിയ(NH3)യേക്കാള് ക്ഷാരത കൂടുതൽ അമീനുകള്(R-NH2)ക്കായിരിക്കും. ക്ഷാരഗുണത്തിന്റെ ആരോഹണക്രമത്തിൽ അമോണിയയെയും അമീനുകളെയും ഇപ്രകാരം എഴുതാം.
മിസൊമെറിക് ഇഫക്റ്റ്. അപൂരിതയൗഗികങ്ങളിൽ, പ്രത്യേകിച്ച് സംയുഗ്മിതവ്യൂഹങ്ങളിൽ (conjugated systems)ഉണ്ടാകാവുന്ന പൈ ഇലക്ട്രാണ്-വിസ്ഥാപനത്തിന് മിസൊമെറിക് ഇഫക്റ്റ് (mesomeric effect)എന്നു പറയുന്നു. ഇലക്ട്രാണ്-ആസക്തി കൂടുതലുള്ള ആറ്റത്തിലേക്ക് പൈ-ബന്ധത്തിലെ ഇലക്ട്രാണുകള് നീക്കപ്പെട്ടിരിക്കും. ഉദാഹരണമായി കാർബൊണൈൽ-ഗ്രൂപ്പിൽ (> C = O) ഓക്സിജന് ഋണചാർജും കാർബണിന് ധനചാർജും ആംശികമായി കൈവരുന്നുണ്ടെന്നു കരുതേണ്ടിയിരിക്കുന്നു. കാർബൊണൈൽ യൗഗികങ്ങളുടെ (ഉദാ. ആൽഡിഹൈഡുകള്; കീറ്റോണുകള്) രാസപ്രവർത്തനങ്ങള് വ്യാഖ്യാനിക്കുന്നതിന് ഈ ധ്രൂവീകരണം സങ്കല്പിക്കേണ്ടതായിവരും. കാർബൊണൈൽ ഗ്രൂപ്പിന്റെ സംരചന താഴെ പറയുന്ന രണ്ട് അഗ്രസ്ഥ-സംരചനകളുടെ (extreme structures) അനുനാദം (resonance) കൊണ്ടാണ് ചിത്രീകരിക്കപ്പെടുന്നത്:
അതായത് സഹസംയോജകസംരചനയായ I-നും അയോണികസംരചനയായ II-നും ഇടയിലുള്ള ഒന്നാണ് യഥാർഥസംരചന. I-ൽ ക്കാണുന്ന വളഞ്ഞ ശരചിഹ്നം പൈ-ഇലക്ട്രാണുകളുടെ ഓക്സിജനിലേക്കുള്ള നീക്കത്തെ കുറിക്കുന്നു. ഇത്തരം ഗ്രൂപ്പ് ഒരു >C=C< ബന്ധവുമായി സംയുഗ്മിതമാകുമ്പോള്, >C=O ഗ്രൂപ്പിന്റെ മേൽവിവരിച്ച ധ്രുവീകരണംഇലക്ട്രാണുകളിൽക്കൂടി കൂടുതൽ പ്രക്ഷേപിതമാകുന്നു. ആംശികധനചാർജ് > C = O ഗ്രൂപ്പിലെ C-ൽനിന്ന് മറ്റൊന്നിലേക്കു നീക്കപ്പെടുന്നു:
അതായത് C1- നോടൊപ്പം C3-യും ഇലക്ട്രാണ് പോരായ്മ അനുഭവിക്കുന്നു. സംയുഗ്മിതമായ ദ്വിബന്ധങ്ങള് ഇനിയുമുണ്ടെങ്കിൽ ഒന്നിടവിട്ട് C-ആറ്റങ്ങളിലെല്ലാംതന്നെ ഇലക്ട്രാണ്-പോരായ്മ സംജാതമാകുന്നു. പൂരിതവ്യൂഹങ്ങളിലെ (saturated systems) ഇെന്ഡക്റ്റീവ് ഇഫക്റ്റ് മൂലസ്ഥാനത്തുനിന്ന് അകലുന്തോറും ക്ഷയിച്ചുവരുന്നു; എന്നാൽ സംയുഗ്മിതവ്യൂഹത്തിൽ കൂടിയുള്ള മിസൊമെറിക് ഇഫക്റ്റിന് ക്ഷയംവരുന്നില്ല. ബെന്സീന്-വ്യുത്പന്നങ്ങളിൽ മിസൊമെറിക് ഇഫക്റ്റ് വ്യക്തമായി കാണാം. ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ്പോലെ മിസൊമെറിക് ഇഫക്റ്റും തന്മാത്രയുടെ നിമ്നതമാവസ്ഥയിലുള്ള സ്ഥിരമായ ധ്രുവീകരണമായതിനാൽ അവ ഏതു യൗഗികത്തിലുണ്ടോ അതിന്റെ ഭൗതികഗുണധർമങ്ങളിൽ പ്രതിഫലിക്കുന്നു. ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് മുഖ്യമായും പൂരിതഗ്രൂപ്പുകളിലും പൂരിതതന്മാത്രകളിലും കാണപ്പെടുമ്പോള് മിസൊമെറിക് ഇഫക്റ്റ് അപൂരിതയൗഗികങ്ങളിൽ, വിശിഷ്യ സംയുഗ്മിതവ്യൂഹങ്ങളിൽ കാണപ്പെടുന്നു. ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് സിഗ്മാ-ബന്ധങ്ങളിലെ ഇലക്ട്രാണുകളെ സംബന്ധിക്കുന്ന ഒന്നാണ്; മിസൊമെറിക് ഇഫക്റ്റ് പൈ-ബന്ധങ്ങളിലെ ഇലക്ട്രാണുകളെ സംബന്ധിക്കുന്നതും. ഇന്ഡക്റ്റീവ് ഇഫക്റ്റ് പൂരിതശൃംഖലയിൽ അല്പദൂരം മാത്രം അനുഭവപ്പെടുന്നു. മിസൊമെറിക് ഇഫക്റ്റ് ആകട്ടെ സംയുഗ്മിതവ്യൂഹമുണ്ടെങ്കിൽ വലിയ തന്മാത്രകളിൽപ്പോലും ഉടനീളം പ്രക്ഷേപിതമായിക്കാണുന്നു.
ഇന്ഡക്റ്റൊമെറിക്-ഇലക്ട്രാമെറിക് ഇഫക്റ്റുകള്. ഒരു പ്രതിപ്രവർത്തകത്തിന്റെ സാമീപ്യത്താൽ തന്മാത്രയിൽ ഇലക്ട്രാണ്-വിതരണമാറ്റങ്ങള് ഉണ്ടാവുന്നതാണ്-പ്രത്യേകിച്ച് സംക്രമണാവസ്ഥയിൽ (transition state). എന്നാൽ ഈ ഇഫക്റ്റുകള് താത്കാലികങ്ങളായിരിക്കും. പ്രതിപ്രവർത്തകത്തിന്റെ സാമീപ്യം ഇല്ലാതായാൽ ഇഫക്റ്റും ഇല്ലാതാവും; തന്മാത്ര അതിന്റെ പൂർവാവസ്ഥയിലേക്കു പോവുകയും ചെയ്യും. തന്മൂലം പ്രതിപ്രവർത്തനവേളയിലനുഭവപ്പെടുന്ന ഈ ഇഫക്റ്റുകള് തന്മാത്രയുടെ സ്വതവേയുള്ള ഗുണധർമങ്ങളെ സ്വാധീനിക്കുന്നില്ല; പ്രതിപ്രവർത്തനത്തിന്റെ ഗതിയെ സ്വാധീനിക്കുന്നു എന്നുമാത്രം. ഇവിടെ ഇഫക്റ്റ് പ്രക്ഷേപിതമാകുന്നത് ഇന്ഡക്റ്റീവ് രീതിയിലോ മിസൊമെറിക് രീതിയിലോ ആകാം. ഇപ്രകാരം സംഭവിക്കുന്ന പ്രഭാവങ്ങള്ക്കാണ് യഥാക്രമം ഇന്ഡക്റ്റൊമെറിക് ഇഫക്റ്റ് എന്നും ഇലക്ട്രാമെറിക് ഇഫക്റ്റ് എന്നും പറയപ്പെടുന്നത്. 1947-ൽ രസതന്ത്രത്തിന് നോബൽസമ്മാനം ലഭിച്ച റോബർട് റോബിന്സണും ഇന്ഗോള്ഡ്, ലാപ്വർഥ് എന്നീ പ്രസിദ്ധവൈജ്ഞാനികരുമാണ് ഇതിനെപ്പറ്റി വിശദമായി പഠനം നടത്തിയത്.
(ഡോ.കെ.പി. ധർമരാജയ്യർ)